Indhold
- Hovedforskel
- Sammenligningstabel
- Hvad er ioniske forbindelser?
- Hvad er molekylære forbindelser?
- Ioniske forbindelser mod molekylære forbindelser
Hovedforskel
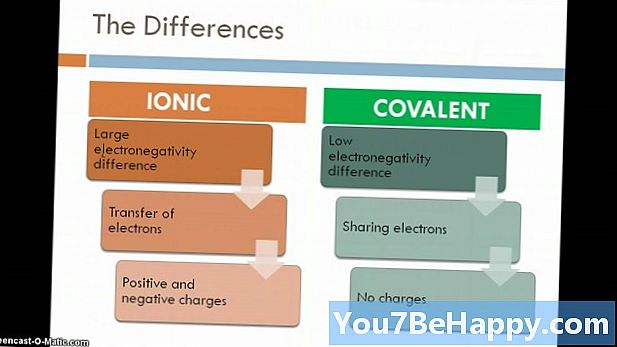
Forbindelse genkendes som et stof, der dannes, når to eller flere elementer kombineres i bestemte proportioner gennem en kemisk binding. Ionisk forbindelse er forbindelsen dannet på grund af elektrostatisk tiltrækningskraft mellem metaller og ikke-metaller. Normalt forekommer de ioniske forbindelser i en solgt krystallinsk tilstand. Desuden er ioniske forbindelser gode ledere af elektricitet og har høje smelte- og kogepunkter. På den anden side dannes molekylære forbindelser på grund af deling af elektroner mellem to ikke-metaller. I forhold til ionisk forbindelse er de dårlig leder af elektricitet og har lavt smelte- og kogepunkt.
Sammenligningstabel
| Ioniske forbindelser | Molekylære forbindelser | |
| dannelse | Ioniske forbindelser dannes på grund af elektrostatisk tiltrækningskraft mellem metaller og ikke-metaller. | Molekylære forbindelser dannes på grund af deling af elektroner mellem to ikke-metaller. |
| Gruppe | Ioniske forbindelser dannes mellem metal og ikke-mentalt. | Molekylære forbindelser dannes, når to ikke-metaller kemisk kombineres |
| Bånd | Ionisk forbindelse dannes på grund af elektrostatisk tiltrækningskraft kendt som ionisk binding. | Molekylære forbindelser dannes på grund af kovalent binding mellem elementerne. |
| Smelte- og kogepunkt | Høj | Lav |
| Stat | Ioniske forbindelser er altid i fast tilstand med dannelse af krystallinsk udseende. | Molekylære forbindelser kan være i en hvilken som helst tilstand, fast stof, væske eller gas ved stuetemperatur. |
| Dirigent for elektricitet | godt | Bad |
Hvad er ioniske forbindelser?
Disse forbindelser dannes på grund af elektrostatisk tiltrækningskraft mellem metaller og ikke-metaller. Med enklere ord får kraften (ionisk binding) i dette en positiv og negativ ladet reaktion sammen for at fremstille en forbindelse. Normalt forekommer de ioniske forbindelser i en solgt krystallinsk tilstand og er gode ledere af elektricitet med høje smelte- og kogepunkter. Ioniske forbindelser dannes mellem metaller og ikke-metaller og har en slags skinnende udseende.
Eksempel: Bordsalt (NaCl) er det mest almindelige eksempel på ionisk forbindelse. I denne formation er natrium (NA) metal, medens klor (Cl) er ikke-metal, begge holdes sammen på grund af den elektrostatiske tiltrækningskraft mellem dem begge.
Hvad er molekylære forbindelser?
Forbindelserne dannet på grund af deling af elektroner mellem ikke-metaller er kendt som Molecular Compound. Elementerne, der reagerer heri, holdes sammen på grund af den kovalente binding, og det er grunden til, at disse forbindelser ofte benævnes kovalente forbindelser.I forhold til ionisk forbindelse er de dårlig leder af elektricitet og har lavt smelte- og kogepunkt.
Eksempel: I Ozone (O3) kombineres ilt med deling af elektroner til dannelse af Ozon.
Ioniske forbindelser mod molekylære forbindelser
- Ioniske forbindelser dannes på grund af elektrostatisk tiltrækningskraft mellem metaller og ikke-metaller, mens molekylære forbindelser dannes på grund af deling af elektroner mellem to ikke-metaller.
- Molekylære forbindelser dannes, når to ikke-metaller kemisk kombineres, på den anden side dannes ioniske forbindelser mellem metal og ikke-mentalt.
- Molekylære forbindelser dannes på grund af kovalent binding mellem elementerne, mens ionisk forbindelse dannes på grund af elektrostatisk tiltrækningskraft, der er kendt som ionisk binding.
- Molekylære forbindelser har lavt smelte- og kogepunkt sammenlignet med de ioniske forbindelser.
- Molekylære forbindelser kan være i en hvilken som helst tilstand, fast stof, væske eller gas ved stuetemperatur, medens ioniske forbindelser altid er i fast tilstand med dannende krystallinsk udseende.
- Molekylære forbindelser er dårlig leder af elektricitet, mens ioniske forbindelser er god leder af elektricitet.


